orimabs技術領域
抗原製備
抗體庫
抗體發現
| 抗體工程
抗體生產
抗體應用
|
為(wei) 了產(chan) 生抗體(ti) ,一步是製備重組抗原蛋白。我們(men) 擁有用於(yu) 重組蛋白表達的三個(ge) 表達平台,包括哺乳動物細胞(CHO和HEK293無血清係統),酵母和大腸杆菌表達係統。
對於(yu) 人類抗原,哺乳動物表達係統是理想的表達係統,因為(wei) 其重折疊和翻譯後修飾(例如糖基化)接近天然抗原。在大多數情況下,細胞表麵抗原的細胞外結構域(例如腫瘤標誌物)是抗體(ti) 生成的目標域。需要製備細胞外結構域的重組蛋白,而不是完整的表麵蛋白(包括單個(ge) 或多個(ge) 跨膜和細胞內(nei) 結構域)。然而,部分地由於(yu) 其天然易位方式的改變而僅(jin) 表達天然蛋白的一部分是非常具有挑戰性的。為(wei) 了克服這個(ge) 問題,我們(men) 開發了幾種新穎的哺乳動物表達載體(ti) ,它們(men) 能夠使這種困難表達蛋白高水平表達。
有時為(wei) 了確保用於(yu) 文庫篩選的抗原處於(yu) 其天然構象,我們(men) 使用抗原陰性和陽性細胞係來篩選文庫。我們(men) 有一個(ge) 慢病毒表達係統來創建抗原高表達細胞係。抗原的高表達與(yu) 細胞內(nei) EGFP的表達有關(guan) ,因此可以通過熒光激活細胞分選術(FACS)純化高表達的細胞。
酵母展示是一種用於(yu) 抗體(ti) 發現的新開發技術。與(yu) 噬菌體(ti) 展示相比,酵母展示具有以下優(you) 勢:真核表達,利用FACS分選來選擇性分離不同親(qin) 和水平群體(ti) 的能力以及方便地通過FACS檢測抗原結合,這使得酵母展示成為(wei) 發現新抗體(ti) 的有力工具。
然而,很大程度上由於(yu) 酵母轉化效率低而構建大的酵母展示抗體(ti) 文庫是非常具有挑戰性的。我們(men) 開發了一種技術,可使酵母轉化效率比傳(chuan) 統方法提高1000倍,從(cong) 而有可能有效地構建大型酵母展示抗體(ti) 庫。
除了優(you) 化酵母轉化效率外,我們(men) 還開發了新穎的酵母展示載體(ti) ,可以在單體(ti) 或二聚體(ti) 中展示scFv,具有*的標簽和接頭,可有效克隆,展示,檢測和保護scFv的結構和功能不受影響由共表達的AGA2蛋白和標簽組成(圖1)。
如果將分離的scFv的終目標工程化為(wei) 二聚體(ti) ,例如scFv-Fv或完整抗體(ti) ,則建議使用二聚體(ti) scFv庫,因為(wei) 高親(qin) 和力單體(ti) scFv可能不會(hui) 轉化為(wei) 高親(qin) 和力的二聚體(ti) 。如果scFv是終的抗體(ti) 形式,例如標記納米顆粒或開發基於(yu) scFv的成像探針,則建議將單體(ti) scFv顯示庫用於(yu) scFv分離。有時抗原隻有很小的口袋抗原決(jue) 定簇,這很可能在小肽抗原中觀察到,全尺寸的scFv太大而無法適合小的口袋抗原決(jue) 定簇,一個(ge) 僅(jin) 包含VH或VL的單結構域文庫將是理想的屏幕。
我們(men) 還開發了一種使用重組蛋白,標簽融合蛋白或基於(yu) 細胞的篩選的綜合文庫篩選策略(圖1)。從(cong) 文庫分離的scFv親(qin) 和力通常在單體(ti) 的納摩爾範圍內(nei) ,並且當被工程化以進行調光時,例如scFv-Fc或完整抗體(ti) ,親(qin) 和力通常將增加約10倍。

插圖1:酵母顯示的二聚體(ti) 和單體(ti) scFv。
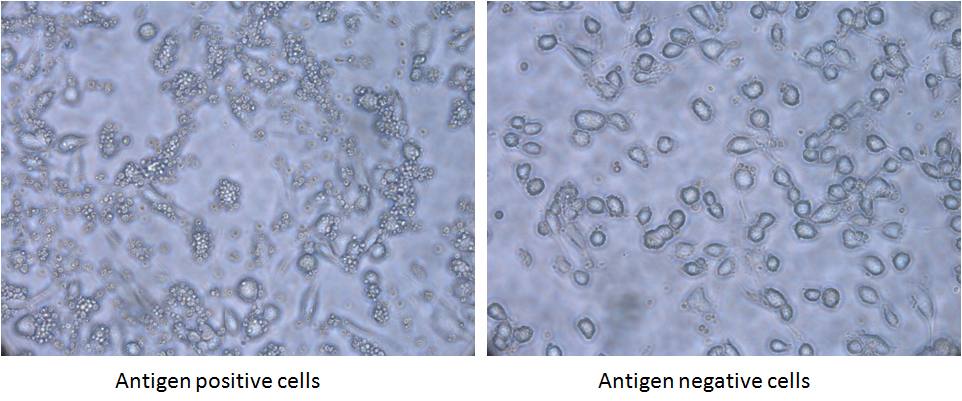
圖1:基於(yu) 細胞的酵母展示抗體(ti) 文庫淘選。
酵母展示對於(yu) Fab文庫的構建是具有挑戰性的,因為(wei) 很難以適當的比率同時表達VH和VL / VK兩(liang) 者以使VH和VL / VK之間100%偶聯。因此,我們(men) 的Fab文庫是使用噬菌體(ti) 展示構建的。OriMAbs已開發出用於(yu) Fab庫構建的噬菌體(ti) 展示係統。兩(liang) 組噬菌粒,pDCK1和pDCK1.1;以及pDCL1和pDCL1.1分別設計用於(yu) κ和λ鏈Fab展示。兩(liang) 種載體(ti) 均具有IgG1 CH1恒定區,並且所有恒定區均已針對大腸杆菌進行了密碼子優(you) 化。表達和所有酶被設計為(wei) 方便消化和有效克隆。噬菌粒pDCK1和pDCL1也可以用於(yu) scFv展示,其中,接頭中的酶位點也被優(you) 化以確保翻譯的接頭對於(yu) VH和VL之間的有效偶聯是靈活的。
使用*的技術和新穎的展示載體(ti) pYDS2(展示調節劑scFvs),OriMAbs從(cong) B淋巴細胞中分離出了1x1011酵母展示調節劑scFv庫,該B淋巴細胞來自於(yu) 56例健康供體(ti) 的5升外周血。總共分離出6.9 mg總RNA,並從(cong) 中純化了125.3 mg mRNA,並使用能夠挽救所有人類抗體(ti) 庫的新型引物用於(yu) 逆轉錄和VH,VK和VL擴增。ScFv在釀酒酵母上以較暗的方式顯示EBY100通過AGA1和AGA2之間的相互作用使細胞表麵應變。在測序的24個(ge) 克隆中,所有克隆均包含scFv基因,其中83.3%具有單個(ge) scFv基因,16.7%具有2個(ge) scFv基因。Flag標簽在100%克隆中表達,而V5標簽在83.3%(20/24)克隆中表達(圖2)。V5標簽表達失敗是由於(yu) scFv基因發生移碼突變,可能是種係中編碼截短抗體(ti) 或PCR引入的真實序列(3/24)或構象障礙(1/24)。通過磁選和流選與(yu) 該文庫隔離(圖3)。建議將該庫用於(yu) scFv發現,以便將scFv工程化為(wei) 二聚體(ti) ,例如scFv-Fc或完整抗體(ti) 。
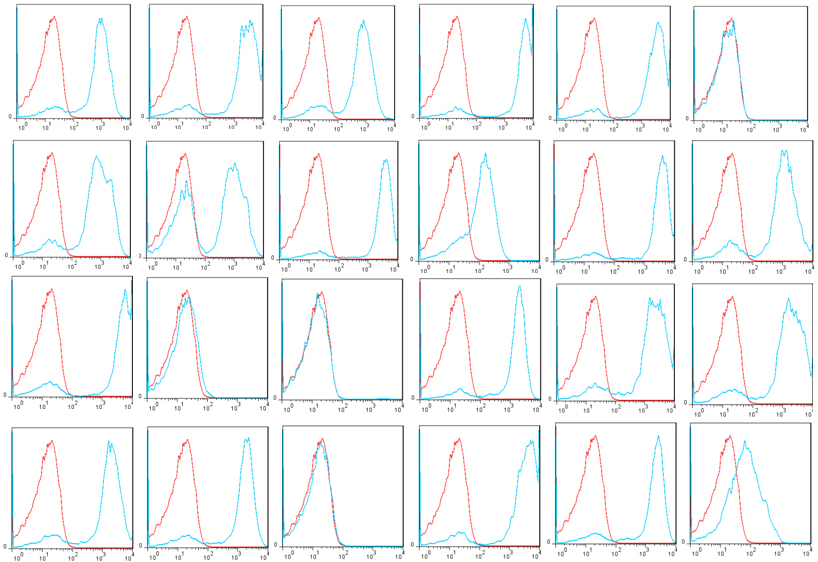
圖2:在24個(ge) 酵母克隆中的V5表達顯示了人類天然的scFv文庫。紅色:陰性對照;藍色:V5標簽表達
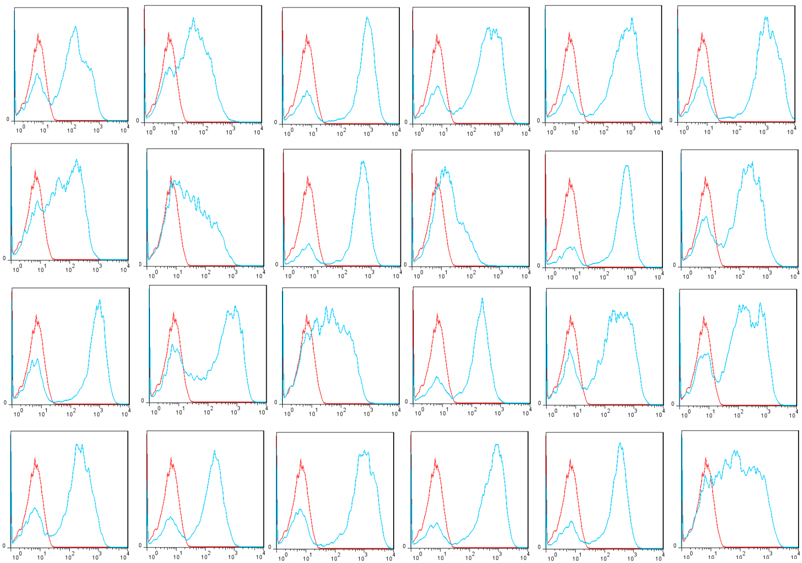
圖3:在24個(ge) 酵母克隆中的標誌表達顯示了人類天然的scFv文庫。紅色:陰性對照;藍色:標誌標記表達
還使用不同的酵母展示載體(ti) pYDS1和相同的VH,VK和VL基因構建了酵母展示的人類天然單體(ti) scFv庫,用於(yu) 二聚體(ti) -scFv庫的構建。庫大小為(wei) 1.2×10 ^ 11。建議將該庫用於(yu) scFv發現,因為(wei) scFv將是應用程序的終格式。
還使用酵母展示載體(ti) pYDS1和相同的VH,VK和VL基因構建了酵母展示人類樸素單域文庫,用於(yu) 單體(ti) 或二聚體(ti) -scFv文庫的構建。庫大小為(wei) 5×10 ^ 9。推薦該文庫用於(yu) 發現隻有小口袋表位的抗原的單域抗體(ti) 。
我們(men) 使用分離自56個(ge) 健康供體(ti) 的相同5 L外周血的VH和VL池,使用載體(ti) pDCK和pDCL(kappa:lambda = 2:1)構建了2×1010 Fab噬菌體(ti) 展示文庫。評估的12個(ge) 克隆顯示100%VK / VL插入和91.6%(11/12)VH插入。
我們(men) 還開發了一種使用重組蛋白,標簽融合蛋白或基於(yu) 細胞的篩選的綜合文庫篩選策略(圖1)。庫平移包括2-3輪磁選,然後是2-3輪精細流選。排序的高親(qin) 和力酵母展示群體(ti) 可直接使用流式細胞儀(yi) 進行個(ge) 體(ti) 克隆鑒定,或轉化為(wei) 分泌型scFv亞(ya) 庫,並使用高通量ELISA進行個(ge) 體(ti) 克隆鑒定。鑒定出的scFv將被表達和純化以用於(yu) 表征,例如親(qin) 和力測量和插入分析,然後進入下遊工程流程。從(cong) 文庫中分離出的scFv親(qin) 和力在單體(ti) 中通常處於(yu) 納摩爾範圍內(nei) (圖4),通常在經過調光後,親(qin) 和力會(hui) 增加約10倍,

圖4:樣品scFvs a和b的親(qin) 和力測量。
我們(men) 已經開發了固相和液相的噬菌體(ti) 展示文庫淘選。直接在固相(例如ELISA板或免疫管)上的抗原包被可能會(hui) 使抗原構象變形,結果可能丟(diu) 失一些表位,從(cong) 而降低分離的抗體(ti) 的多樣性,或者分離的抗體(ti) 可能根本不結合天然構象抗原。為(wei) 了克服這個(ge) 潛在的問題,我們(men) 已經開發液相淘選法,其中,無論是抗原和抗體(ti) 在其天然構象。抗原結合的噬菌體(ti) 群體(ti) 將通過磁選分離,分離的可溶性Fab抗體(ti) 將在大腸杆菌中產(chan) 生。
從(cong) 抗體(ti) 庫中分離的單結構域抗體(ti) ,scFv或Fab抗體(ti) 通常需要進行工程改造以用於(yu) 不同的目的,例如,可以將它們(men) 改造為(wei) scFv-Fc或全抗體(ti) ,以實現更高的親(qin) 和力,更好的穩定性和更長的循環時間。我們(men) 提供所有已知格式的抗體(ti) 的設計和工程改造,例如scFv,二聚體(ti) scFv,Fab,F(ab')2,單結構域抗體(ti) ,scFv-Fc和全抗體(ti) 。
通常,從(cong) 我們(men) 的文庫中分離出的抗體(ti) 具有納摩爾範圍的親(qin) 和力,當工程化為(wei) 二聚體(ti) 時,親(qin) 和力將增加約10倍。因此,從(cong) 我們(men) 的文庫生成的抗體(ti) 通常不需要親(qin) 和力成熟。如果需要更高的親(qin) 和力,我們(men) 可以選擇通過酵母和噬菌體(ti) 展示技術進行親(qin) 和力成熟。
酵母展示的優(you) 勢在於(yu) ,可以使用熒光輔助細胞分選術(FACS)輕鬆對抗原結合的酵母菌群進行分選,因為(wei) 酵母菌的大小足以被FACS識別。這使酵母菌的展示比噬菌體(ti) 在親(qin) 和力成熟方麵更有效,因為(wei) 除了用於(yu) 噬菌體(ti) 展示的抗原濃度管理和嚴(yan) 格洗滌之外,FACS在直接將高親(qin) 和力酵母種群從(cong) 其他培養(yang) 基轉化為(wei) 高親(qin) 和力酵母菌方麵更有效(圖xx) 。

圖5:用於(yu) 抗原結合的高親(qin) 和力酵母群體(ti) 的流式分選。
我們(men) 已經開發了用於(yu) 抗體(ti) 表達的表達係統,包括用於(yu) 以細胞內(nei) 或分泌形式表達單結構域抗體(ti) ,scFv和Fab的大腸杆菌係統;用於(yu) 單結構域抗體(ti) ,scFv和Fab分泌表達的酵母係統; 和用於(yu) 所有片段抗體(ti) 和全抗體(ti) 的分泌表達的哺乳動物係統。我們(men) 提供通過這些表達係統生產(chan) 和純化所有抗體(ti) 形式的服務。
抗體(ti) 藥物偶聯物(ADC)是一種新興(xing) 的抗體(ti) 治療技術。抗體(ti) (通常是全抗體(ti) )通過可裂解或不可裂解的連接子用超毒性藥物(例如MMAE,MMAF和DM1)標記,以特異性地向抗原陽性細胞傳(chuan) 遞毒性。死細胞釋放的毒素(MMAE和DM1)也可以通過旁通機製進入並殺死附近的抗原陽性細胞。我們(men) 提供與(yu) 這些藥物結合的完整抗體(ti) 和相關(guan) 特性的服務。
雙特異性抗體(ti) (一個(ge) 臂使用抗CD3抗體(ti) 靶向T細胞,另一臂使用腫瘤特異性抗體(ti) 靶向腫瘤細胞)充當將T細胞和腫瘤細胞結合在一起並激活T細胞殺死腫瘤的橋梁。我們(men) 提供設計,構建,表達和評估雙特異性抗體(ti) 的服務。
光學成像是一種用於(yu) 體(ti) 內(nei) 抗體(ti) 生物分布研究的方便且有用的方法,例如小鼠中的抗原表達譜研究,小鼠模型中的腫瘤靶向評估。由於(yu) 近紅外(NIR)染料在組織中的深度滲透(大約1 cm),因此常用於(yu) 這些研究。我們(men) 提供與(yu) 這些染料和相關(guan) 表征有效結合和純化片段抗體(ti) 或完整抗體(ti) 的服務。
電話
QQ掃一掃

